一种新的递送方法——通过外膜囊泡将目标蛋白富集并传递到细胞质中
Enrichment and delivery of target proteins into the cell cytosol via Outer Membrane Vesicles
研
究

背
景
近日亲和生命在ACS Applied Materials & Interfaces期刊发表了题为“Enrichment and delivery of target proteins into the cell cytosol via Outer Membrane Vesicles”的相关论文,在禾立春博士的引领下公司研发团队通过对蛋白质递送机理的深入研究,创新性建立了一种新的递送方法来实现蛋白质向胞质的递送。
新的递送方式是将目的蛋白高效地富集到了OMVs腔中,对其进行了特异性标记,并递送进了真核细胞胞质中,成功地建立了一种基于OMVs的蛋白质胞内递送体系。
三
大

突
破

01
将细菌外膜囊泡(OMVs)作为蛋白质递送的载体,实现了目的蛋白在OMVs中的高效富集,浓度可达62mg/ml;
02
将细菌外膜囊泡(OMVs)作为蛋白质递送的载体,利用小分子可自由进出OMVs的特点,完成了对OMVs中目的蛋白的特异性标记;
03
将细菌外膜囊泡(OMVs)作为蛋白质递送的载体,成功构建了一种以OMVs为载体向胞内递送蛋白质的方法。

蛋白质作为最重要的生物分子之一,在基础科学研究和生物医学治疗方面已经得到了广泛的应用。一方面,经过特殊处理的蛋白质在包括细胞成像、生物诊断、信号通路分析等多项研究中提供标记和参考;另一方面,对药物开发来说,蛋白质类药物因其具有活性高、特异性强、毒性低和生物功能明确等特点,越来越受到了国内外学者的关注。然而,由于受到细胞膜通透性的限制,蛋白质药物一般靶向于膜外受体,此类蛋白质药物一旦被有效地递送进细胞中,将会很大程度上扩大疾病治疗的效果,提供更多包括纳米抗体在内的治疗方案,也可以治疗更多的疾病。
在过去的几十年里已经建立起包括物理方法、细胞穿膜肽、脂质体、纳米载体等多种方法用于细胞内蛋白质递送,但大多数方法或多或少都存在一些限制,比如包括电穿孔、显微注射、纳米针在内的物理方法往往会对细胞膜造成损伤,而且操作复杂,通量小;纳米载体需要与货物非共价结合,因此,它们往往针对具有某一表面特征的一类蛋白进行递送,并不具有普适性,同时,递送载体的毒性也是需要考虑的问题,纳米载体在体内残留带来的毒性往往会对机体造成负累,在与载体结合时,蛋白的纯度往往需要达到一定的要求,而不同蛋白的表达纯化过程复杂、成本高、普适性差,在表达纯化过程中还存在药物残留、蛋白粒径不均一等问题。

细菌外膜囊泡(OMVs)是一种在细菌生长过程中产生的,直径在50-250纳米的球形膜结构。OMVs能包载一系列货物分子,包括脂多糖、肽聚糖、膜、胞质和胞质蛋白、毒素和核酸,从而影响包括毒力、水平基因转移、噬菌体感染、细胞代谢产物的运输以及细菌-细菌或细菌-宿主相互作用在内的多种生物过程。目前OMVs已经作为一种佐剂广泛应用于疫苗生产中,另外已有研究表明OMVs膜主要由脂质和蛋白质构成,结构与细胞膜类似,表现出极高的生物相容性,具有作为新型药物递送载体的巨大潜力。
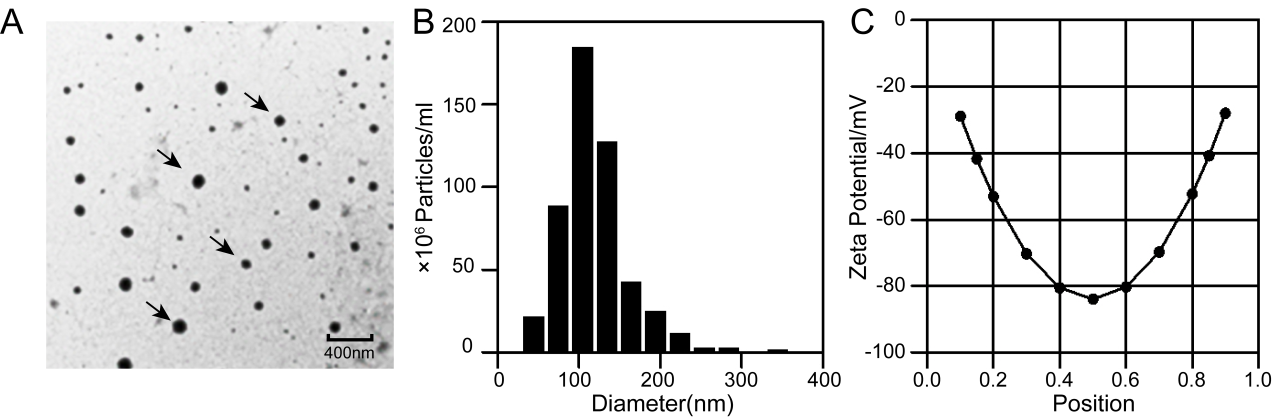
图1 OMVs样品的性质
研发团队首先对获得的OMVs样品进行表征,对其形态、粒径、电位进行观察和分析,证明获得了结构完整,性质稳定的OMVs样品。
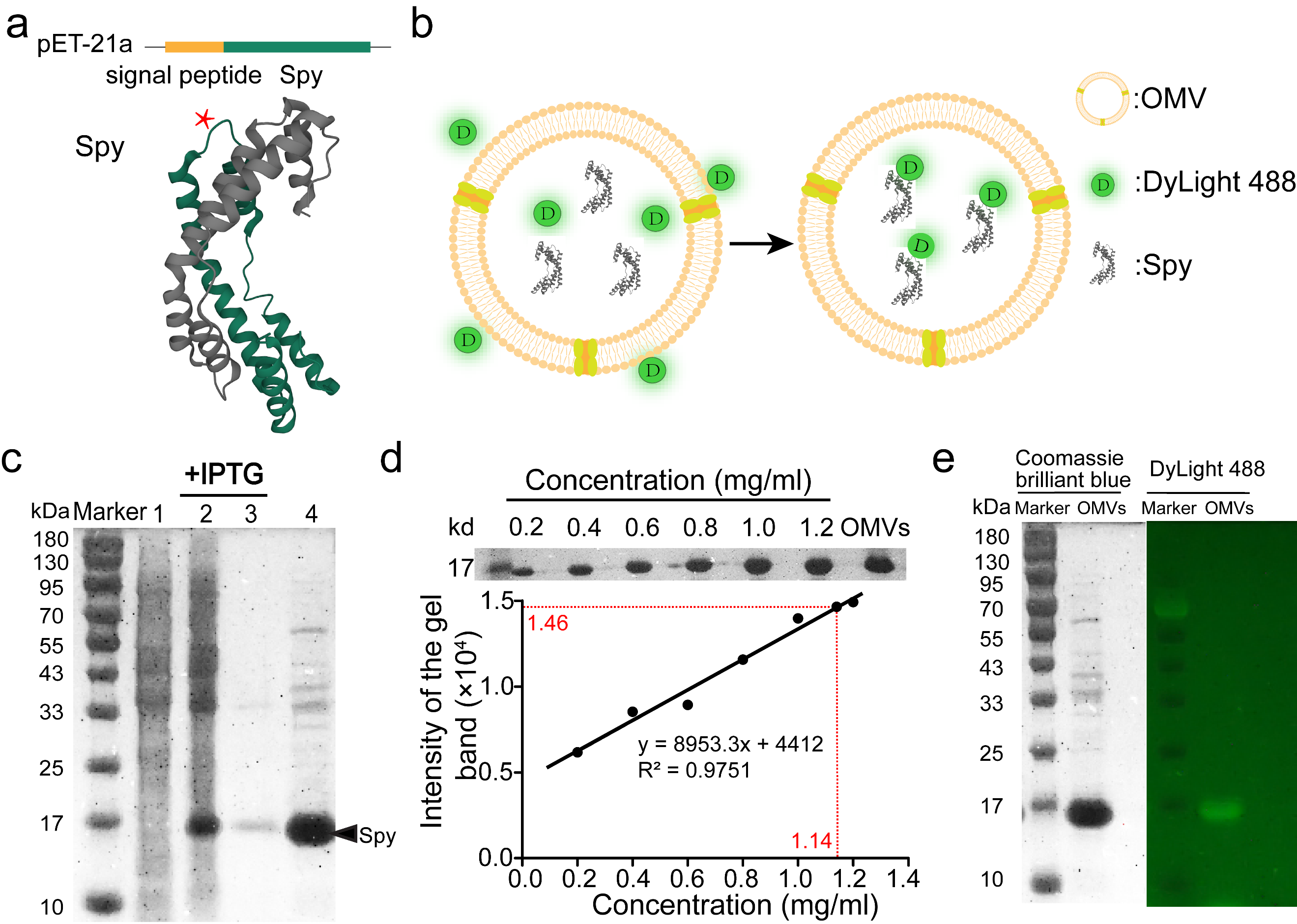
图2 对OMVs腔内目的蛋白的富集和标记
为了将目的蛋白装载到OMVs中,研发团队构建了分泌型表达质粒(图2a),将目的蛋白(Spy)分泌达到周质中,进而装载到OMVs中,对蛋白组分进行分析,发现Spy蛋白被大量富集在OMVs中,浓度可达62mg/ml(图2 c、d)并且可以利用荧光探针自由进出OMVs的特性,成功标记了腔中的目的蛋白(图2 e)。
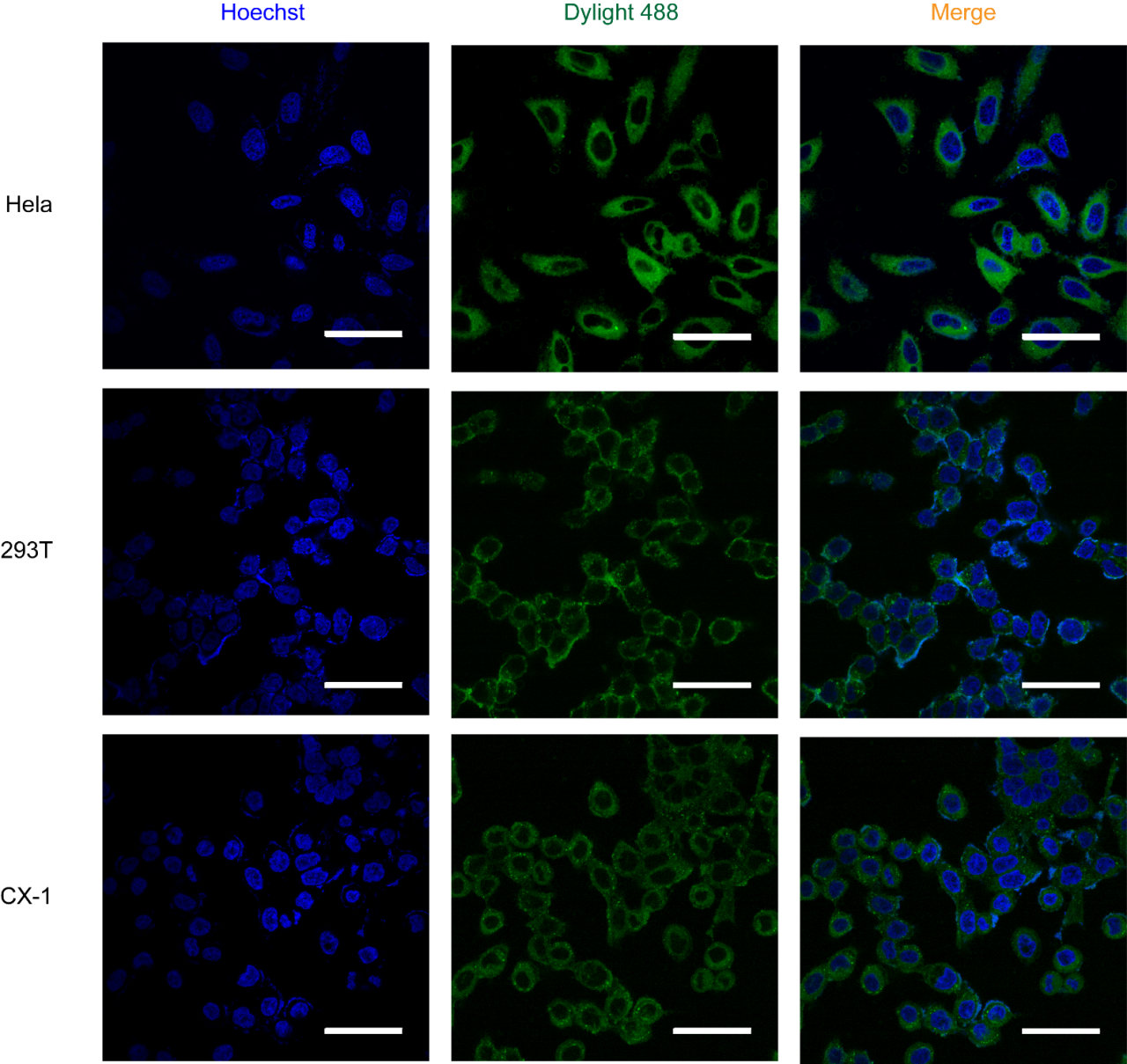
图3 标记Spy T72C蛋白的OMVs转染不同细胞后的CLSM图像
共聚焦显微镜结果显示,OMVs与多种细胞系仅仅通过简单孵育的方式,就实现了目的蛋白向胞质的递送(图3),递送效率可达90%左右。
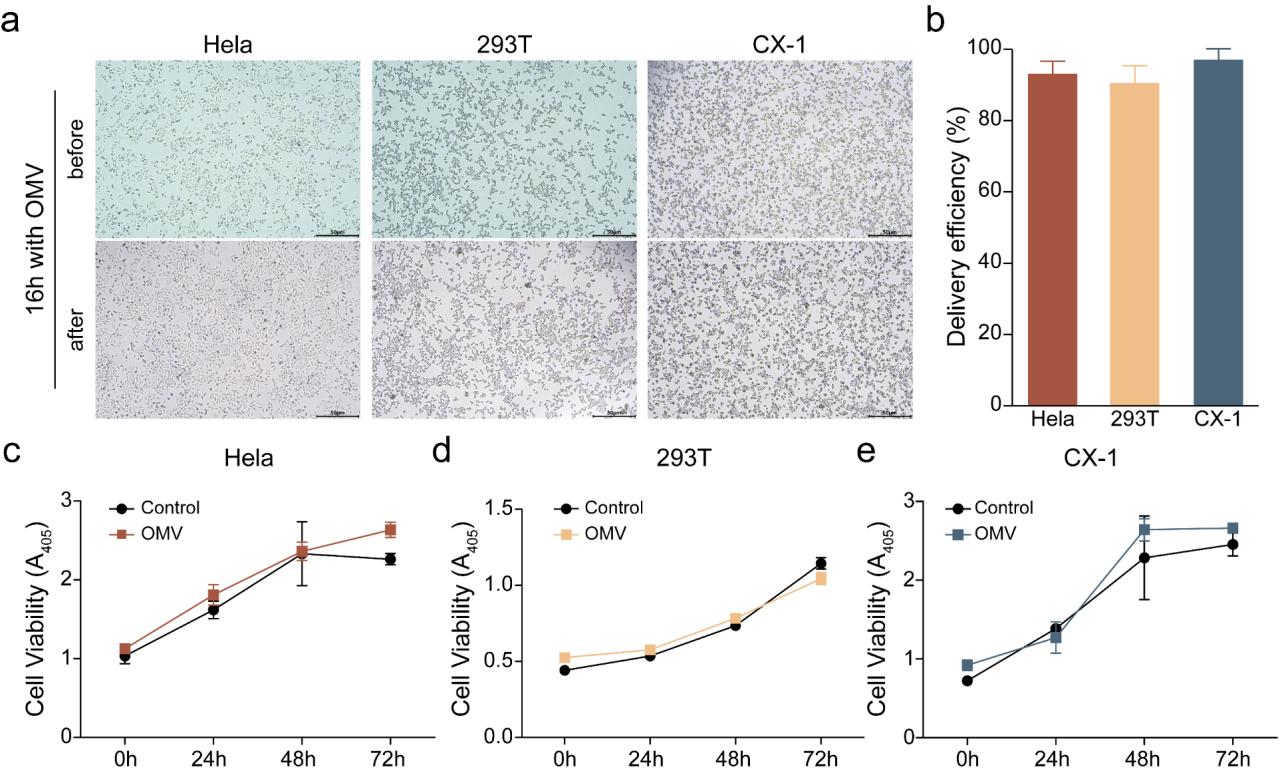
图4聚焦显微镜结果
研发团队对OMVs的细胞毒性进行了简单分析,结果发现,在细胞水平上,OMVs对细胞正常生长在72小时内无明显影响(图4)。
另外,研发团队对大肠杆菌来源的OMVs的递送机制也进行了初步探索,进一步验证了其在多种细胞中的递送,均以内吞的方式进行(图5)。
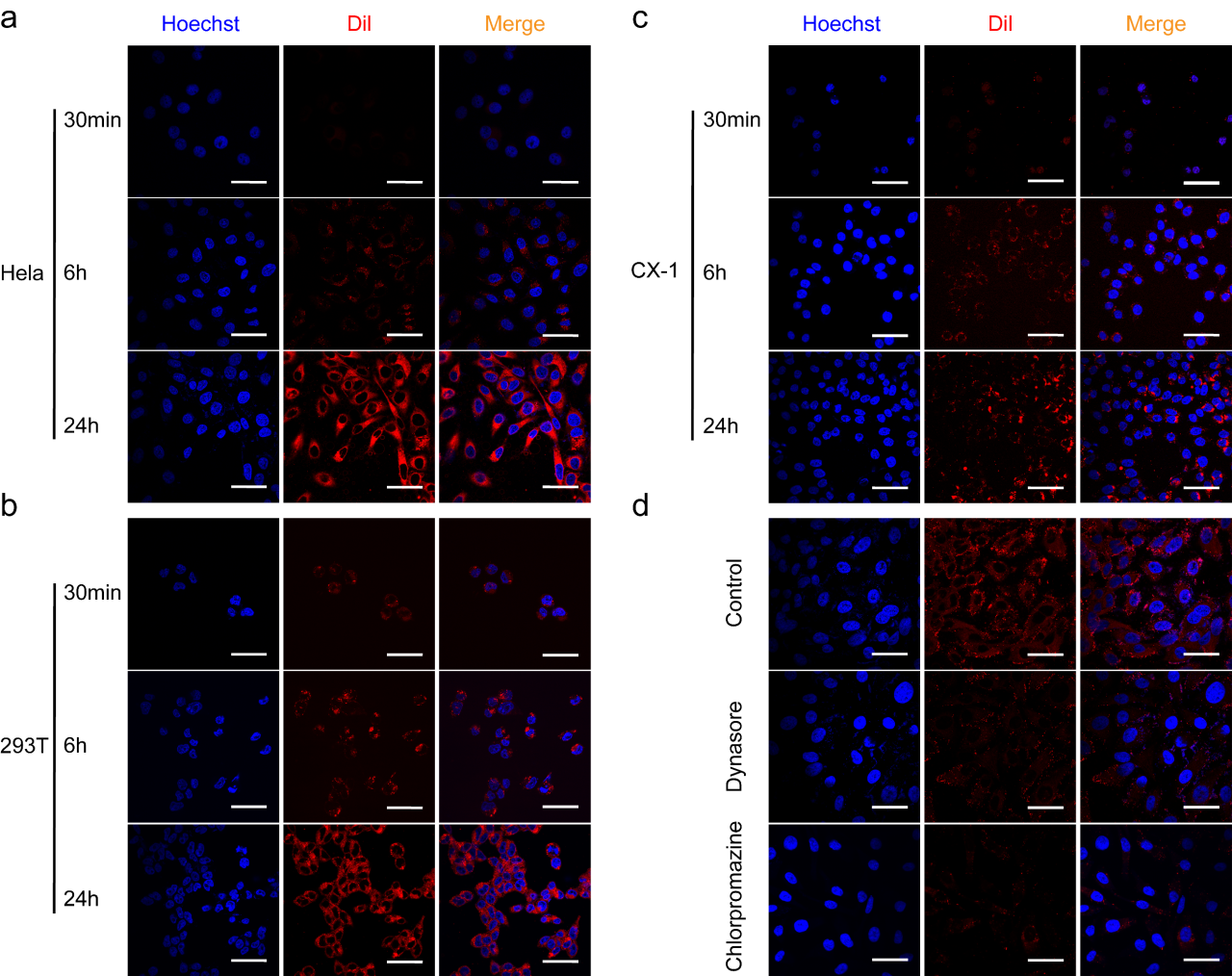
图5 用Dil标记OMV孵育
另外,作者对大肠杆菌来源的OMVs的递送机制也进行了初步探索,进一步验证了其在多种细胞中的递送,均以内吞的方式进行(图5)。
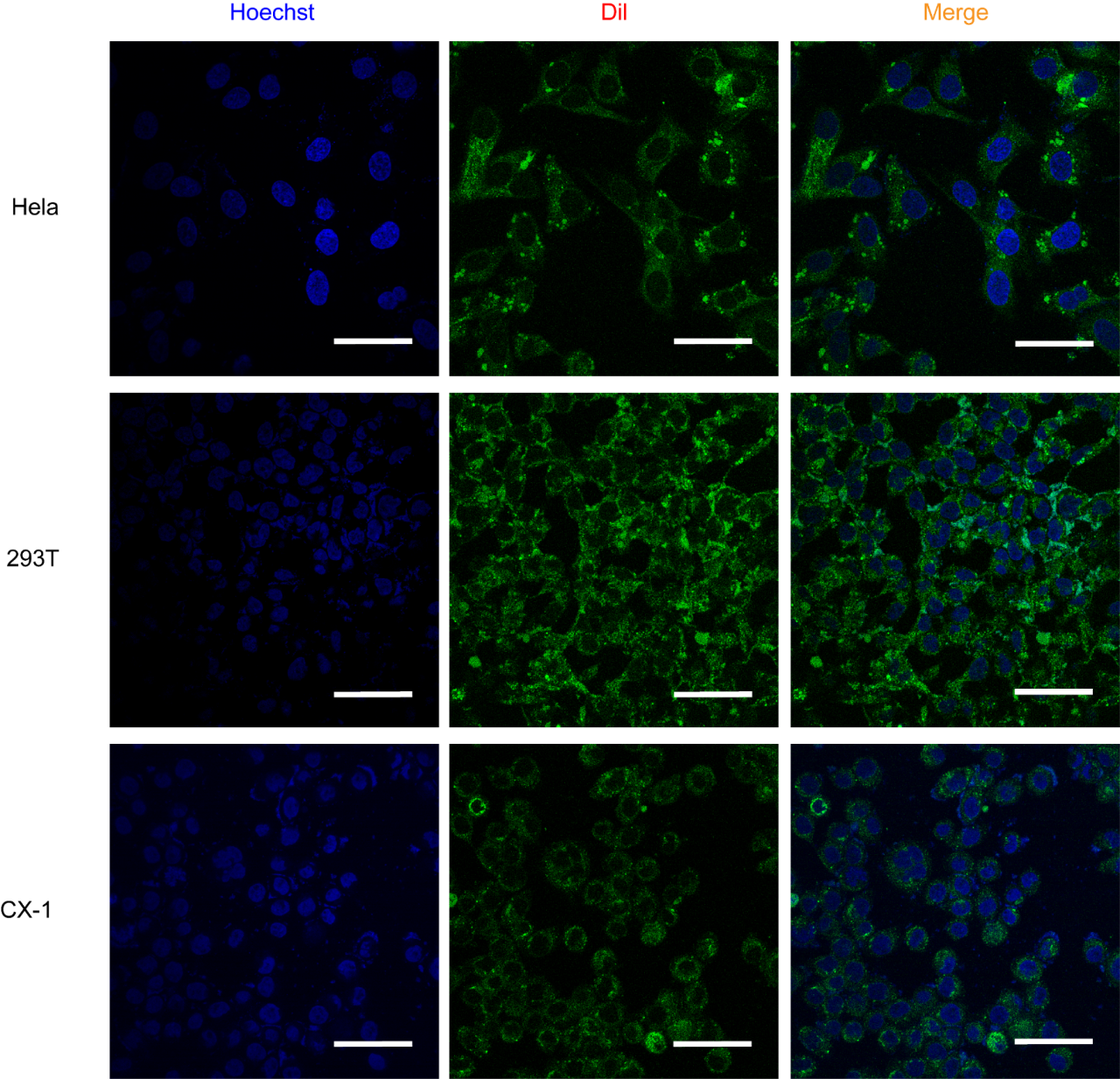
图6 将标记后的纳米抗体通过OMVs递送至不同细胞系
装载标记纳米抗体的OMVs与HeLa、293T、CX-1细胞孵育12h后的共聚焦图像,比例尺为50 μm。
尝试将纳米抗体以同样的方式装载到OMVs中进行递送,共聚焦显微镜图像的结果证实了纳米抗体利用该体系进行递送的可能性(图6),ELISA结果进一步证明,利用OMVs递送进细胞的纳米抗体仍保持活性(图7)。
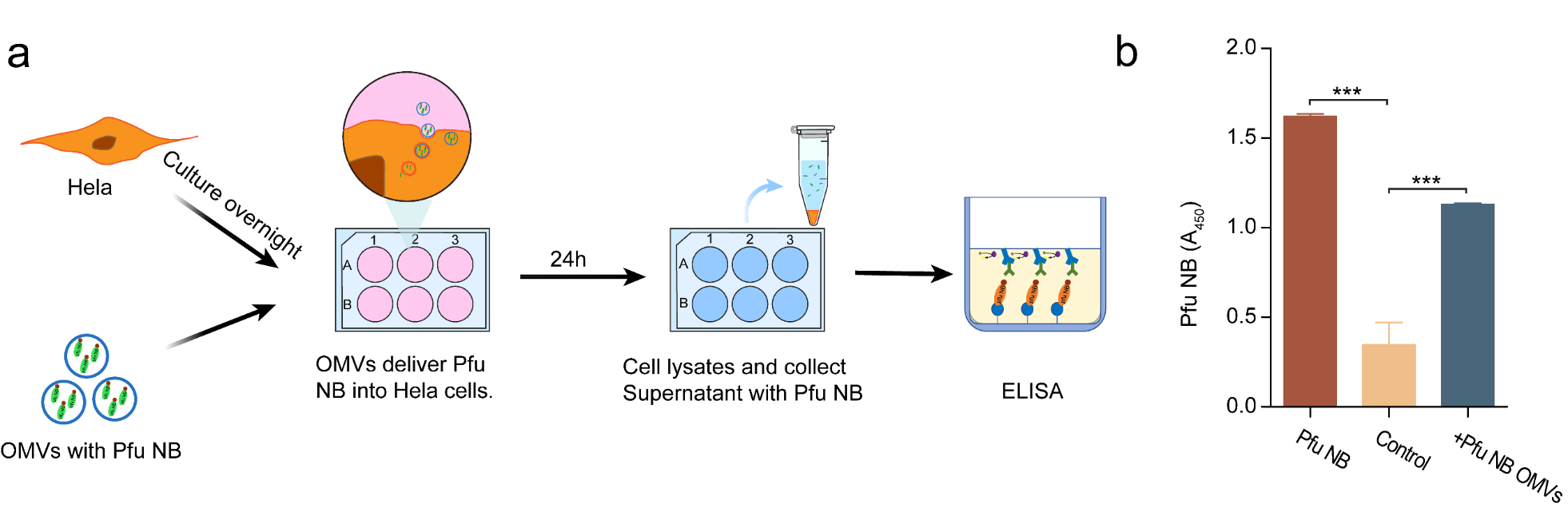
图7 Pfu纳米抗体经OMVs转染后的生物活性验证
基于上述实验数据,将目的蛋白高效地富集到了OMVs腔中,对其进行了特异性标记,并递送进了真核细胞胞质中,成功地建立了一种基于OMVs的蛋白质胞内递送体系。